Cinética química (continuação)
Veremos agora alguns exemplos. De acordo com a reação da síntese da amônia, veja o problema seguinte:
O gás hidrogênio é consumido a uma taxa de 18 mols a cada 4 minutos. Calcule:
a) a velocidade de consumo do N2
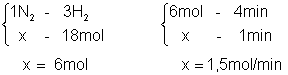
b) a taxa de formação do NH3

c) a massa consumida de H2 por minuto

d) a massa obtida de NH3 por minuto

Durante uma reação química, a concentração dos reagentes (B) vai diminuindo, enquanto a concentração dos produtos vai aumentando (A).

Fonte: http://cesarmauriciosantos-fisqui.blogspot.com/2008_09_01_archive.html
A concentração dos reagentes pode ou não chegar a zero. Se a concentração dos reagentes for diminuindo, a velocidade da reação também vai diminuindo. Quando terminar a reação, a velocidade será zero.

FONTE: http://inorgan221.iq.unesp.br/quimgeral/respostas/graph.gif
Velocidade de consumo e de produção
A velocidade média de consumo é a medida de reagente que é consumida, “desaparece” na reação, por unidade de tempo.
A velocidade média de produção é a medida de produto formado durante a reação, por unidade de tempo. Seja a reação genérica:
![]()
Neste caso, o reagente também pode ser chamado de reatante.
A equação química pode apresentar o coeficiente estequiométrico de cada reagente. Este coeficiente representa o número de mols da substância. Veja uma equação química genérica, onde a, b, c e d são coeficientes estequiométricos e A, B, C e D são as substâncias químicas.
![]()
Velocidade de consumo dos reagentes:
![]()
![]()
Exemplo: ![]()
![]()
Velocidade de formação dos produtos:
![]()
![]()
Condições para que ocorra uma reação química
Para que uma reação química ocorra, é necessário que haja contato e afinidade química entre os reagentes. Uma das condições mais importantes para a ocorrência de uma reação química é a energia de ativação e as colisões entre as moléculas dos reagentes.































