Reações químicas
As substâncias podem combinar-se com outras substâncias, transformando-se em novas substâncias. Para estas transformações damos o nome de reações químicas.
Reação química é um fenômeno onde os átomos permanecem intactos. Durante as reações, as moléculas iniciais são "desmontadas" e os seus átomos são reaproveitados para "montar" novas moléculas.
No nosso cotidiano, há muitas reações químicas envolvidas, como por exemplo no preparo de alimentos, a própria digestão destes alimentos no nosso organismo, a combustão nos automóveis, o aparecimento da ferrugem, a fabricação de remédios, etc.


Equação química
A forma que representamos a reação química chama-se equação química.
Equação Química - é a representação gráfica da reação química.
Nela, colocamos os elementos que estão envolvidos na reação, de forma abreviada, e como ela aconteceu, através de símbolos já padronizados. As equações químicas representam a escrita usada pelos químicos e de forma universal, ou seja, é a mesma em qualquer país.
As substâncias que participam da reação química são chamadas de produtos ou reagentes na equação química.
Reagentes (1° membro) – são as substâncias que estão no início da reação. São as que irão reagir, sofrer a transformação.
Produtos (2° membro) – são as substâncias resultantes da reação química.
Exemplo: Duas moléculas de gás hidrogênio juntam-se com uma molécula de gás oxigênio, formando duas moléculas de água.
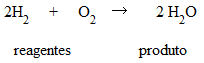
Observe que o H2 e o O2 são reagentes e H2O é o produto.
Para representar a reação química, utiliza-se uma seta apontando para o lado direito, indicando a transformação.
Em cima da seta, são utilizados alguns símbolos indicando as condições nas quais a reação deve ocorrer.
∆ - calor
aq – aquoso (em água)
cat – catalisador
λ – energia luminosa
Em cada substância pode haver os seguintes símbolos:
↑ - desprendimento de gás
↓ - precipitação de um sólido
Nas equações químicas, as substâncias podem aparecer com seus estados físicos:
(s) – sólido
(l) – líquido
(g) – gasoso
Exemplo:
C (s) + O2 (g) → CO2 (g)































