Título (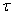 ) e percentual (%)
) e percentual (%)
É a relação entre soluto e solvente de uma solução dada em percentual (%). Os percentuais podem ser:
- Percentual massa/massa ou peso/peso: %m/m ; %p/p
![]()
- Percentual massa/volume: %m/V ; %p/V
![]()
- Percentual volume/volume: %v/v
![]()
Exemplos:
NaCl 20,3% = 20,3g em 100g de solução
50% de NaOH = 50g de NaOH em 100mL de solução (m/v)
46% de etanol = 46mL de etanol em 100mL de solução (v/v)
O título não possui unidade. É adimensional. Ele varia entre 0 e 1.
O percentual varia de 0 a 100.
![]() ou
ou ![]()
Para encontrar o valor percentual através do título:
![]()
Relação entre concentração comum, densidade e título:
![]()
Relação entre outras grandezas:
![]()
Ou simplesmente:
![]()
![]()
Acompanhe os exemplos:
1) Uma solução contém 8g de NaCl e 42g de água. Qual o título em massa da solução? E seu título percentual?
![]() % = ?
% = ?
![]()
![]()
![]()
![]()
![]()
![]()
2) No rótulo de um frasco de HCl há a seguinte informação:
título percentual em massa = 36,5%
densidade = 1,18g/mL
Qual a molaridade desse ácido?
Transformar o percentual em título:
![]()
Depois aplicar a fórmula:
![]()
![]()
![]()
Para achar a molaridade:
![]()
![]()
![]()































